トップページ > 最新情報 > 新着情報 > 新型コロナウイルス・デルタ変異株のSpike-P681RおよびD950N変異の機能解析
新型コロナウイルス・デルタ変異株のSpike-P681RおよびD950N変異の機能解析
2023年4月21日
国立大学法人東京大学
国立国際医療研究センター
国立感染症研究所
ポイント
- 新型コロナウイルスのリバースジェネティクス法を利用して、デルタ変異株に特徴的なスパイク蛋白質におけるP681R変異およびD950N変異の機能解析を行った。
- P681R変異はスパイク蛋白質の開裂と膜融合を促進し、D950N変異は膜融合をわずかに促進した。
- 既報とは異なり、P681R変異およびD950N変異はハムスターにおける病原性をわずかに上昇させたが有意な差はなく、これらの変異のみではウイルスの病原性は大きく変化しないと考えられる。
発表内容
東京大学医科学研究所ウイルス感染部門の河岡義裕特任教授と国立感染症研究所感染病理部の鈴木忠樹部長らの研究グループは、リバースジェネティクス法(注1)を用いてP681RおよびD950Nの機能解析を行いました。その結果、既報(Saito et al. Nature, 2021)とは異なり、P681R変異およびD950N変異はハムスターにおける病原性をわずかに上昇させたが有意な差はなく、これらの変異のみではウイルスの病原性は大きく変化しないことが示唆されました。
新型コロナウイルスは2019年末に中国で確認されて以来、ウイルスゲノムに多くのアミノ酸変異を獲得しながら流行を繰り返しています。デルタ変異株(注2)は2020年にインドで確認され、急速に世界中に感染拡大しました。デルタ株のスパイク蛋白質(注3)には複数のアミノ酸変異が認められますが、P681R変異およびD950N変異は、その他の主要な流行株では検出されておらず、デルタ株に特徴的なアミノ酸変異です。
はじめに研究グループは、祖先型の新型コロナウイルス(Wuhan-D614G)と、それに両アミノ酸変異の一方もしくは両方を導入した3種類のウイルス(Wuhan-D614G/P681R, Wuhan-D614G/D950N, Wuhan-D614G/P681R/D950N)を作製しました。また、野生型のデルタ株(delta)と、これらの変異の一方もしくは両方を元に戻した3種類のデルタ株 (delta-R681P, delta-N950D, delta-R681P/N950D)を作製しました。
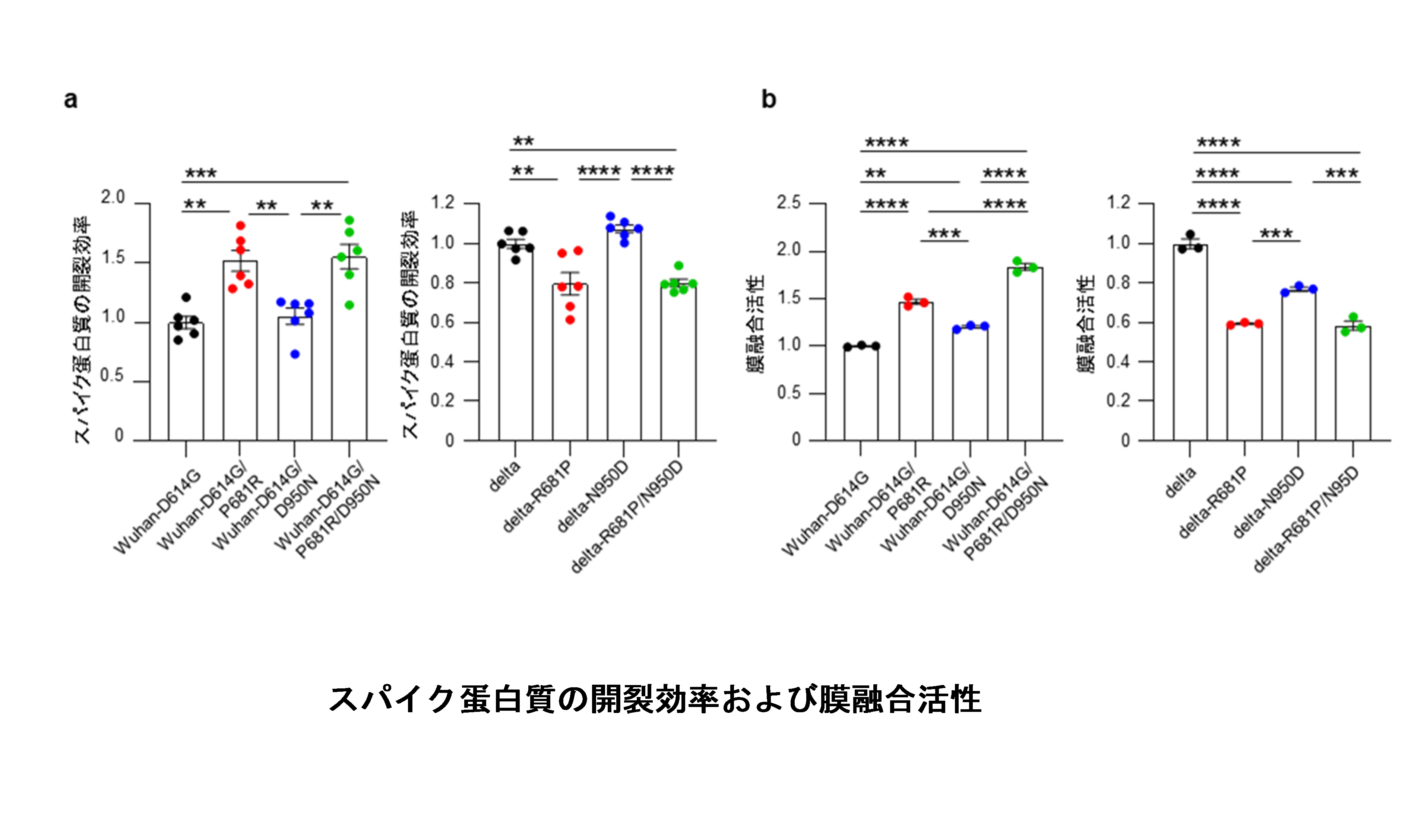
作製した8種類のウイルスを用いてスパイク蛋白質の開裂効率を比較したところ、P681Rはスパイク蛋白質の開裂を促進することが明らかになりました(図1a)。一方、D950Nは開裂効率に影響しませんでした。また、スパイク蛋白質を介した膜融合活性を比較したところ、P681Rは膜融合を促進し、D950Nも膜融合をわずかに促進することが示唆されました(図1b)。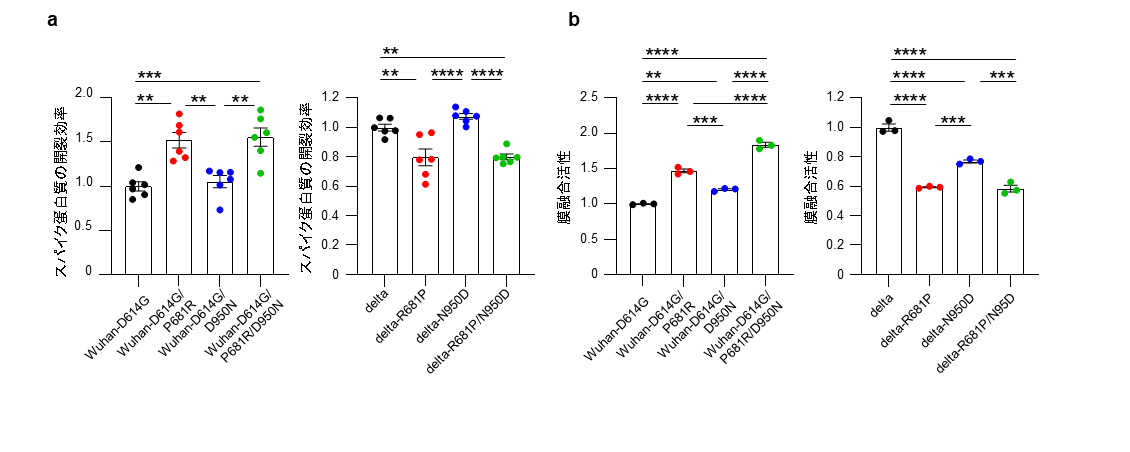
(a)各ウイルスをVeroE6/TMPRSS2細胞に感染させ、感染細胞中のスパイク蛋白質をwestern blottingで検出した。開裂していないスパイク蛋白質の量と開裂しているスパイク蛋白質の量の比を算出することによって開裂効率を測定した。P681Rによってスパイク蛋白質の開裂が促進された。
(b)スパイク蛋白質を発現させた細胞とその受容体であるACE2蛋白質を発現させた細胞を共培養し、膜融合活性を測定した。P681Rによって膜融合活性が上昇し、D950Nによってもわずかに膜融合活性の上昇が見られた。
さらに、培養細胞における増殖性を比較したところ、VeroE6細胞ではP681Rによってウイルスの増殖性が有意に低下することが明らかになりました。
VeroE6/TMPRSS2細胞でもP681Rはわずかにウイルスの増殖性を低下させました。Calu-3細胞ではP681Rによってウイルスの増殖性に変化は認められませんでした。一方D950Nは、いずれの細胞においてもウイルスの増殖性に影響しませんでした(図2)。培養細胞における増殖性の差には、開裂効率の上昇に伴うスパイク蛋白質の安定性の変化および細胞種によるウイルスの侵入経路の違いが関与していると考えられます。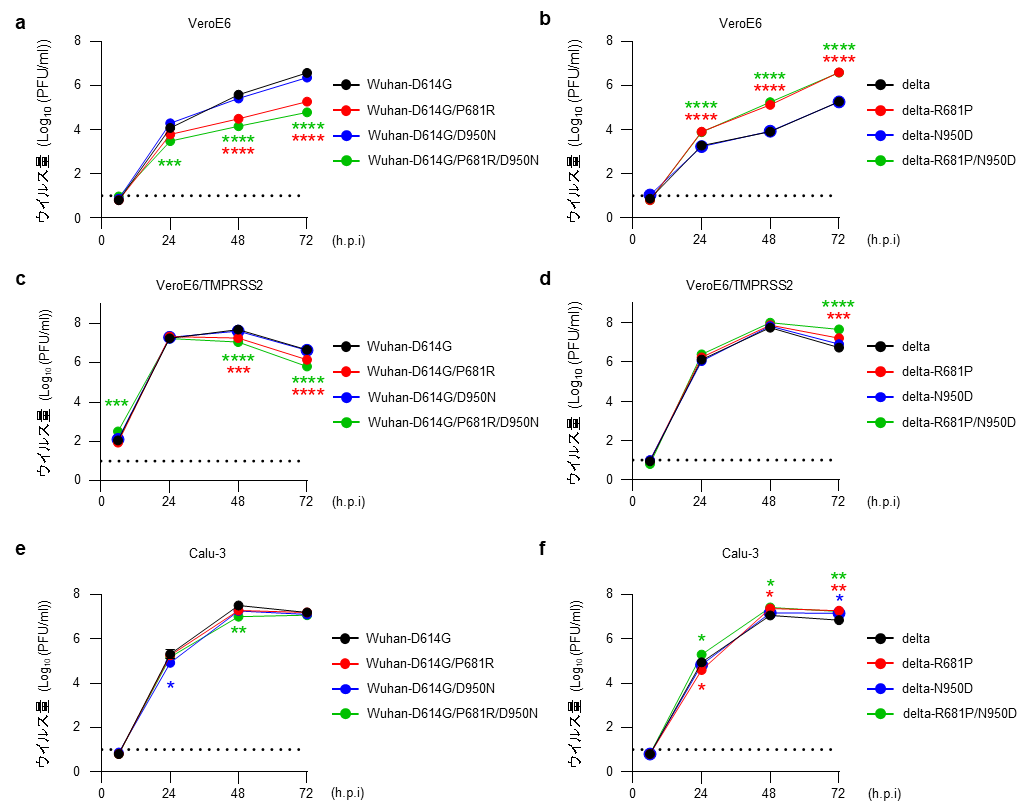
各ウイルスをVeroE6細胞(a,b)、VeroE6/TMPRSS2細胞(c,d)およびCalu-3細胞(e,f)に感染させ、感染性ウイルス量を経時的に測定した。VeroE6細胞ではP681Rによってウイルスの増殖性が低下し、VeroE6/TMPRSS2細胞でもわずかにその傾向が見られた。(h.p.i: hours post infection, 感染後時間)
続いて、これらのウイルスのハムスターにおける病原性を比較しました。P681RやD950Nを持つウイルスを感染させたハムスターの体重は、持たないウイルスを感染させたハムスターの体重よりも減少率がわずかに大きいものの有意差はありませんでした(図3a,c)。また、これらのアミノ酸変異は、呼吸機能(図3b,d)や肺および鼻甲介におけるウイルスの増殖性(図3e,f)に大きな影響を与えませんでした。さらに、肺の病理像にも差は見られませんでした。従って、P681RおよびD950Nだけではウイルスの病原性に大きな変化を与えないことが示唆されました。
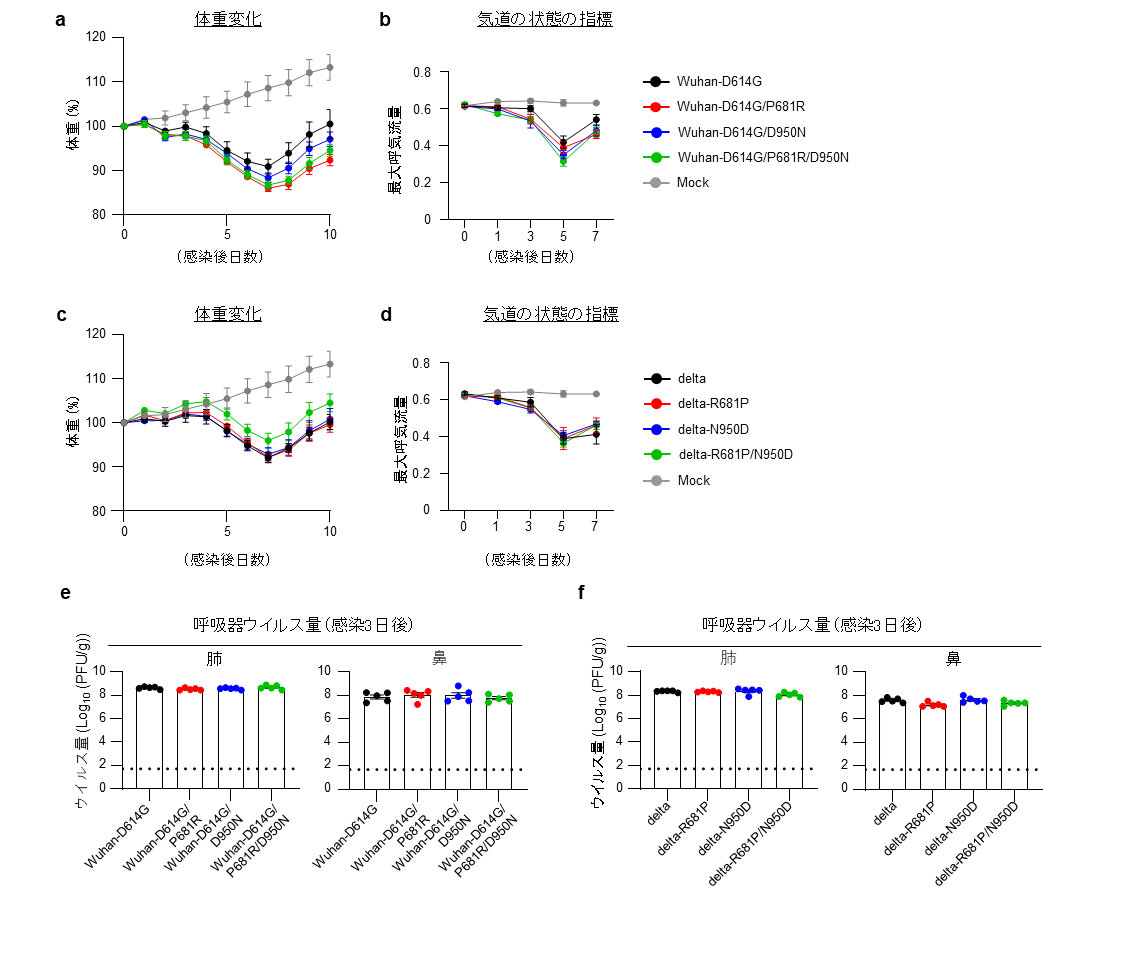
各ウイルスをハムスターの鼻に接種した。
(a,c)接種後、非感染ハムスター(Mock)と感染ハムスターの体重を毎日測定した。P681RやD950Nによってわずかに体重変化の程度が変化したが有意な差はなかった。
(b,d)呼吸機能の評価指標の1つである最大呼気流量は、気道の状態を測定できる指標である。P681RやD950Nによって有意な差はなかった。
(e,f)感染後3日目の鼻甲介と肺における感染性ウイルス量を測定した。P681RやD950Nによって有意な差はなかった。
本研究グループは、リバースジェネティクス法によって作製した変異ウイルスと感染動物モデルを用いて、既報 (Saito et al. Nature, 2021)とは異なり、デルタ株に特徴的なP681RおよびD950N変異は、ウイルスの病原性に大きな影響を与えないことを示唆しました。しかし、これらの変異はスパイク蛋白質の開裂や膜融合を促進することが明らかになり、他のアミノ酸変異と組み合わさることでウイルスの病原性に影響する可能性があるため、これらを持つ新たな変異株の出現には注意が必要です。
本研究を通して得られた成果は、行政機関が今後の新型コロナウイルス感染症対策計画を策定・実施する上で重要な情報となるのみならず、新型コロナウイルスの病原性解析に有用な知見を提供します。
本研究は4月10日、英国医学誌「eBioMedicine」(オンライン版)に公表されました。
用語解説
(注1)リバースジェネティクス法ウイルスゲノムから感染性ウイルスを人工的に作製する技術。ウイルスゲノムに任意の変異を加えたウイルスを作製できる。新型コロナウイルスのリバースジェネティクス法としては複数の方法が開発されているが、本研究では正確性の高いBacterial artificial chromosome (BAC)を用いた方法で組換えウイルスを作製した。
(注2)デルタ変異株
2020年12月にインドで最初に検出されたB.1.617.2系統に分類されるデルタ株は、オミクロン株が出現するまで世界で最も流行していた変異ウイルスである。
(注3)スパイク蛋白質
コロナウイルス粒子表面に存在する蛋白質。ウイルスが宿主細胞に侵入・感染する際に要となる蛋白質であり、スパイク蛋白質におけるアミノ酸変異は病原性や伝播性に影響を与えることが報告されている。
問合せ先
<研究に関するお問い合わせ>東京大学医科学研究所 ウイルス感染部門
特任教授 河岡 義裕(かわおか よしひろ)
<報道に関するお問い合わせ>
東京大学医科学研究所 国際学術連携室(広報)
E-mail:koho(a)ims.u-tokyo.ac.jp
国立国際医療研究センター 企画戦略局 広報企画室
Tel:03-3202-7181
E-mail:press(a)hosp.ncgm.go.jp
※(a)部分を@マークに変換してください。
- 詳細は以下のファイルをご覧ください。
リリース文書